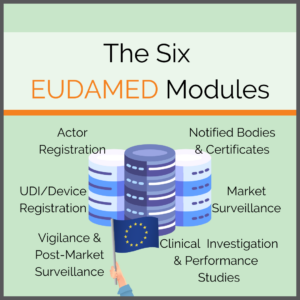
Ein wichtiger Bestandteil der MDR und IVDR ist die EUDAMED. Als zentrale Datenbank soll sie mehr Transparenz schaffen, Informationen bündeln und auch als Austausch- und Meldeplattform für die einzelnen Akteure dienen. Dazu besteht sie aus sechs Modulen, die verschiedene Themenfelder von der Registrierung von Medizinprodukten und Akteuren bis hin zur Marktüberwachung und der Meldung von Incidents abdecken.
Die Europäische Kommission hat mit der EUDAMED ein IT-System entwickelt, welches die Anforderungen der MDR 2017/745 und der IVDR 2017/746 abbildet. Damit ersetzt sie die Eudamed2 Datenbank, die unter den vorherigen Medical Device Directives bestand. Das Akronym EUDAMED steht für EUropean, DAtabase on MEdical Devices.
Die EUDAMED hat verschiedene Funktionen, sie dient unter anderem als
- Registrierungssystem
- Kollaborationssystem
- Meldesystem
- Verarbeitungssystem
Über ihre Module und die daraus resultierende Transparenz für alle Marktteilnehmer sowie die Öffentlichkeit und die Möglichkeiten zum Austausch und der Koordination von Informationen, trägt sie insgesamt zur besseren Zusammenarbeit und einer einheitlichen Informationsbasis bei. Somit bildet sie das Herzstück der MDR und IVDR.
Die sechs EUDAMED Module
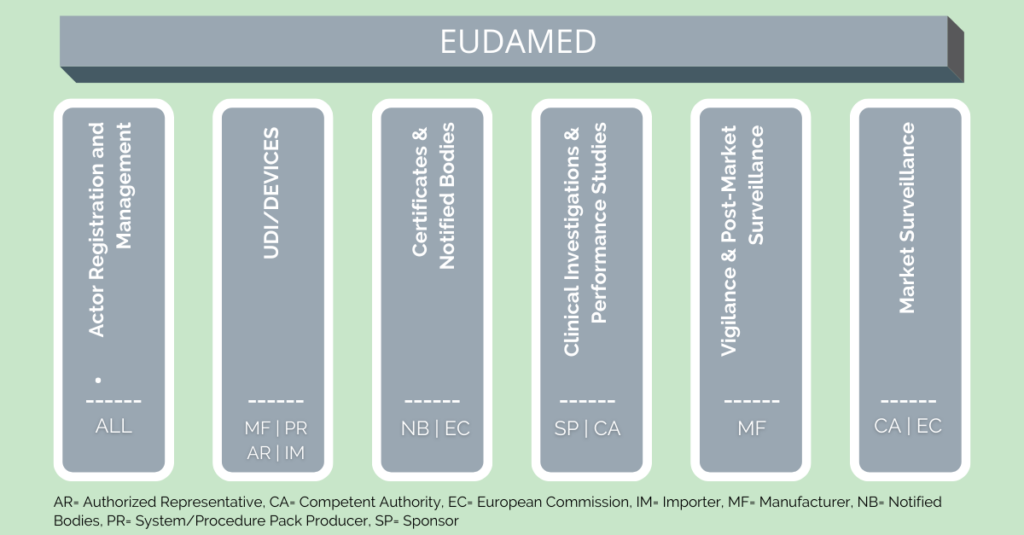
Die EUDAMED ist in sechs zusammenhängende Module gegliedert, deren Inhalte teilweise der Öffentlichkeit zugänglich sind:
- Actor and User Registration and Management
- UDI Database and Registration of Devices
- Certificates and Notified Bodies
- Clinical Investigation and Performance Studies
- Vigilance and Post-market Surveillance
- Market Surveillance
Actor Registration Modul (verfügbar seit Dezember 2020)
Über das Actor-Modul müssen sich alle Akteure bei der EUDAMED registrieren, die in irgendeiner Weise mit ihr kollaborieren. Darunter fallen die Supervising Entities und die Economic Operators. Für Händler besteht keine Registrierungspflicht für die EUDAMED.
Supervising Entities:
- European Commission (EC)
- Competent Authority (CA)
- Designated Authority (DA)
- Notified Bodies (NB)
Economic Operators:
- Manufacturer (MF)
- Authorised Representative (AR)
- System & Procedure Pack Producer (PR)
- Importer (IM)
Alle Akteure bekommen eine Single Registration Number (SRN) zugewiesen, wenn sie sich bei der EUDAMED registrieren. Die SRN dient dazu, alle Economic Operators eindeutig identifizieren zu können. Sie besteht aus dem Country ISO2 Code, der Actor Role Abbreviation und einer neunstelligen Nummer (BE-MF/AR/PR/IM-Number). Es wird pro Rolle eine eineindeutige Nummer vergeben. Hat ein Economic Operator mehrere Rollen inne, so erhält er pro Rolle jeweils eine gesonderte SRN. Entsprechend müssen sich die Akteure seperat für die jeweilige Rolle registrieren. Für Firmen, die nicht in der EU ansässig sind, läuft der Registrierungsprozess über ihren Authorised Representative (AR).
Für die Registrierung im Actor Registration Modul der EUDAMED müssen unter anderem folgende Informationen bereitgestellt werden:
- Name
- Adresse
- Informationen über die Person Responsible for Regulatory Compliance (PRRC)
UDI/Medical Devices Registration Module
Über das UDI-Modul werden alle Medizintechnikprodukte registriert. Alle Hauptinformationen der UDI können hier eingetragen werden, ebenso wie Informationen über Altgeräte. Für die UDI-Daten muss die EMDN Nomenklatur beachtet werden.
Notified Bodies and Certificates Module
Die Hersteller können in diesem Modul die Zertifikate, die ihnen von den Benannten Stellen (Notified Bodies) ausgestellt wurden, hinterlegen. Dies gilt gleichermaßen für QMS- und Konformitätsbewertungszertifikate. Ebenso dient dieses Modul dazu, die Kommunikation zwischen den Benannten Stellen zu ermöglichen, zum Beispiel wenn ein Hersteller einen Antrag zurückzieht. Zudem soll hier der Status der Konsultationsverfahren für klinische Bewertungen einsehbar sein. Öffentlich zugänglich sein sollen die Summaries of Safety and Clinical Performance (SSCP) sowie die entsprechenden Berichte der Benannten Stellen.
Vigilance Module
Über das Vigilance Modul können verschiedene Berichte eingereicht werden und es dient zur Meldung von Incidents:
- Einreichung von Periodic Safety Update Reports (PSUR)
- Einreichung von Periodic Summary Reports (PSR)
- Meldung von schweren Incidents und Field Safety Corrective Actions (FSCA) sowie Field Safety Notices (FSN)
Die FSCAs werden nach ihrer Meldung im Vigilance Modul automatisch an die zuständigen Behörden verteilt. FSN werden veröffentlicht. Im Modul soll es außerdem die Funktion geben, zusammenfassende Berichte zu erstellen.
Clinical Investigations and Performance Studies Module
Das Clinical Investigations and Performance Studies Modul dient zur Verwaltung von klinischen Prüfungs- und Leistungsbewertungsdaten. Es können Anträge für klinische Leistungsstudien/Prüfungen gestellt werden und auch klinische Nachuntersuchungen sowie Änderungen, Berichte etc. nach Markteintritt des Produktes eingereicht werden.
Market Surveillance Module
Dieses Modul soll die Kooperation und Koordination zwischen den einzelnen EU-Mitgliedsstaaten vereinfachen. Es können zum Beispiel Ergebnisse der Marktüberwachung zwischen den einzelnen Behörden und den Benannten Stellen ausgetauscht werden. Außerdem werden die Berichte in diesem Modul auch für die Öffentlichkeit zugänglich gemacht.
Wie geht es weiter mit den EUDAMED Modulen?
Das Actor Registration Module, das UDI/Device Registration Modul sowie das Notified Bodies Modul sind derzeit einsatzbereit. Seit Dezember 2020 haben die Unternehmen die Möglichkeit sich zu registrieren.
| Role | Registrierungen |
| Manufacturer (MF) | 18.859 |
| Authorised Representative (AR) | 1.836 |
| Importer (IM) | 5.571 |
| System/Procedure Pack Producer (PR) | 717 |
Anzahl der Registrierungen im Actor Module, Stand Januar 2023
Die drei übrigen Module sollen nach und nach verfügbar gemacht werden. Stand Januar 2023 sollen sie im zweiten Quartal von 2024, und damit die gesamte EUDAMED, fertiggestellt werden. Bei den vorherigen Modulen gab es aber in der Vergangenheit einige Terminverschiebungen, sodass nicht sicher ist, ob für die drei Module an dem bestehenden Datum festgehalten wird. Ratsam für alle Akteure, insbesondere aber für Hersteller, ist es, proaktiv an den Inhalten für die einzelnen EUDAMED Modulen zu arbeiten. Zwar sind die Übergangsfristen an die Freischaltung der Module geknüpft, dennoch sollte die intensive Auseinandersetzung und Vorbereitung früher geschehen, um später nicht in Verzug zu geraten.
Update (August 2023):
Die Entwicklungszeit der EUDAMED Module soll laut der Europäischen Union bald ein Ende finden. Zuletzt wurde die geplante Timeline im Juni 2022 verschoben. Demnach werden alle sechs Module der europäischen Datenbank im vierten Quartal von 2023 fertiggestellt.
Update (Oktober 2023):
Die EUDAMED erhielt eine weitere Aktualisierung: eine Verlängerung um drei Jahre. Die Entwicklung des Moduls für Clinical Investigation und Performance Studies (CI/PS) wird länger dauern als erwartet.
Der neue Termin für die volle Funktionalität der EUDAMED ist Q2 2027.
Termine, die für Sie als zukünftige Nutzer der EUDAMED wichtig sind:
- Q4 2027 – verpflichtende Nutzung der Module Actor, Market Surveillance, Vigilance und CI/PS
- Q2 2029 – verpflichtende Nutzung der Module Device und Certificates
Eine detailliertere Übersicht der Roadmap finden Sie hier.
Was können wir für Sie tun? Kontaktieren Sie uns gerne für eine unverbindliche Demo unserer MedTech Lösung oder besuchen Sie unsere mytracekey MedTech Produktseite.