UDI Produktdatenmanagement für Medizinprodukte
Product Information Management (PIM) zur Umsetzung globaler Medizinprodukte-Verordnungen
Die Medical Device Regulation (MDR) gilt als eine der komplexesten Regularien weltweit und stellt die Medizinproduktehersteller vor große Hürden. Neben der Neuzertifizierung (Stichwort „Benannte Stellen“) und dem erhöhten Umfang bei klinischen Studien, ist eine der wichtigsten Komponenten der MDR das Sammeln von Produktdaten und das dazugehörige UDI Management. Über die EUDAMED sind sie teilweise öffentlich zugänglich und sollen für mehr Transparenz und Sicherheit sorgen. Medizinprodukte werden durch die Unique Device Identification (UDI) nachverfolgbar, sodass Rückrufe schneller und gezielter durchgeführt und Produktfälschungen besser erkannt werden können.
Medizintechnikunternehmen benötigen ein validiertes und alltagstaugliches System, mit dem Sie die Herausforderung der MDR-UDI und weitere, internationale UDI-Regularien meistern können. Auch Kundengruppen, wie Krankenhäuser und GPOs, stellen Anforderungen an die Qualität und Konsistenz der übermittelten Produktdaten. Die effiziente und sichere Datenverwaltung ist deshalb zu einem wichtigen Thema in der Medizintechnik geworden.
Ihre Vorteile
- Einfache Produktdaten Vorlagen
- Adaptive Support Module
- Produkthierarchien managen
- Single Point of Truth
- Konnektoren zu Behörden & Businesspartnern
- Redundante GxP Cloud Infrastruktur
- Regelmäßige Softwareupdates
Herausforderungen der MedTech-Branche
- Die Produktdaten sind innerhalb der Firma und über verschiedene Partner verteilt
- Die Daten müssen für unterschiedliche Zielmärkte aufbereitet werden
- Manuelle Prozesse sind eine häufige Fehlerquelle
- Unklarheit, welche Daten an EUDAMED für ein bestimmtes Produkt gemeldet werden müssen
- Die Standards für die Produktdaten sind je nach Regularien/Stakeholder verschieden
UDI-Stammdatenmanagement mit tracekey
Unsere mytracekey Plattform für Medizinprodukte unterstützt die Medizintechnikindustrie ihre Produktstammdaten gemäß den regulatorischen Vorgaben, wie der EU-MDR, aufzubereiten und zu verwalten. Durch unsere langjährige Erfahrung in der Life Science Branche, haben wir gelernt, unsere Software-Lösungen an stark regulierte Branchen anzupassen. Deshalb schauen wir uns Ihre Bedürfnisse genau an und entwickeln Software, mit der Sie die Herausforderungen meistern können. Dazu verbinden wir verschiedene Behörden und Systeme, wie beispielsweise die EUDAMED mit Herstellern, Lohnfertigern, Händlern, Krankenhäusern und ihren jeweiligen Businesspartnern.
Vorteile auf einen Blick
- Ein eindeutiger Speicherort ersetzt manuelle Prozesse und Excel-Sheets
- Wir betreuen Sie von Anfang an persönlich und auf Augenhöhe
- Unnötige Produktrückrufe aufgrund fehlerhafter oder inkonsistenter Daten werden verhindert
- Sie managen Ihre Produktdaten von vornherein MDR-konform
- Umfassendes UDI Management
Wir ermöglichen unserem Netzwerk, bestehend aus über 300 Kunden und Businesspartnern, Produktdaten zu verwalten, Seriennummern zu generieren, Daten auszutauschen und weltweite Regularien zu erfüllen – alles an einem Ort zentral verwaltet. Dadurch erhalten Sie einen Single Point of Truth (SPOT), an dem Sie die Produktdaten stets aktuell und compliant vorhalten können.
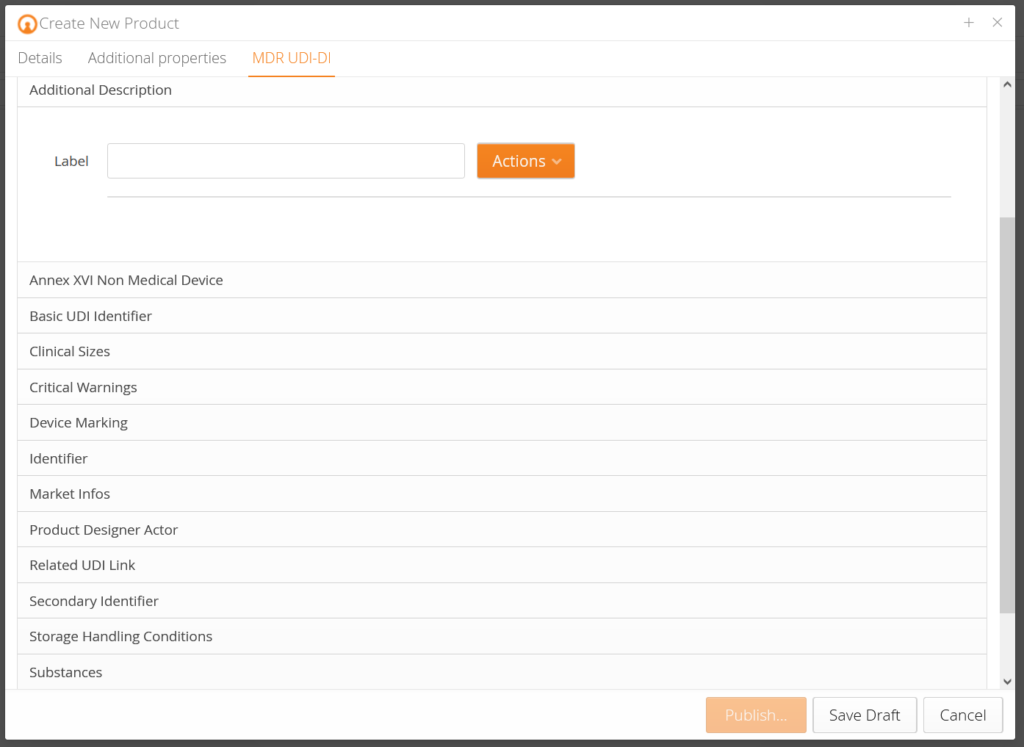
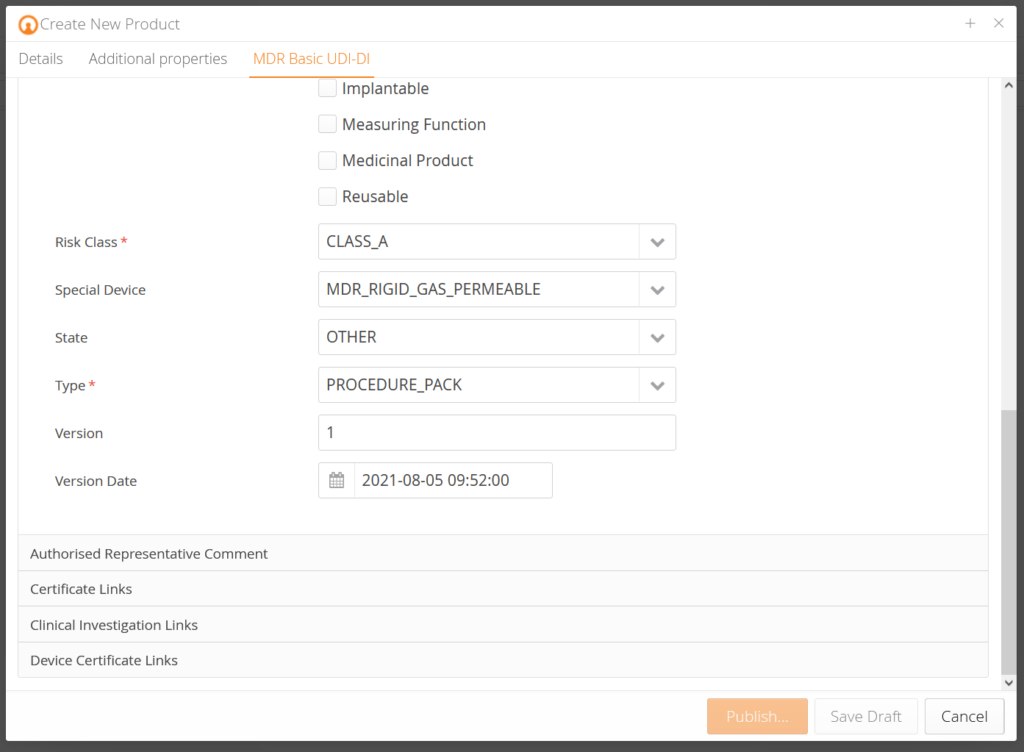
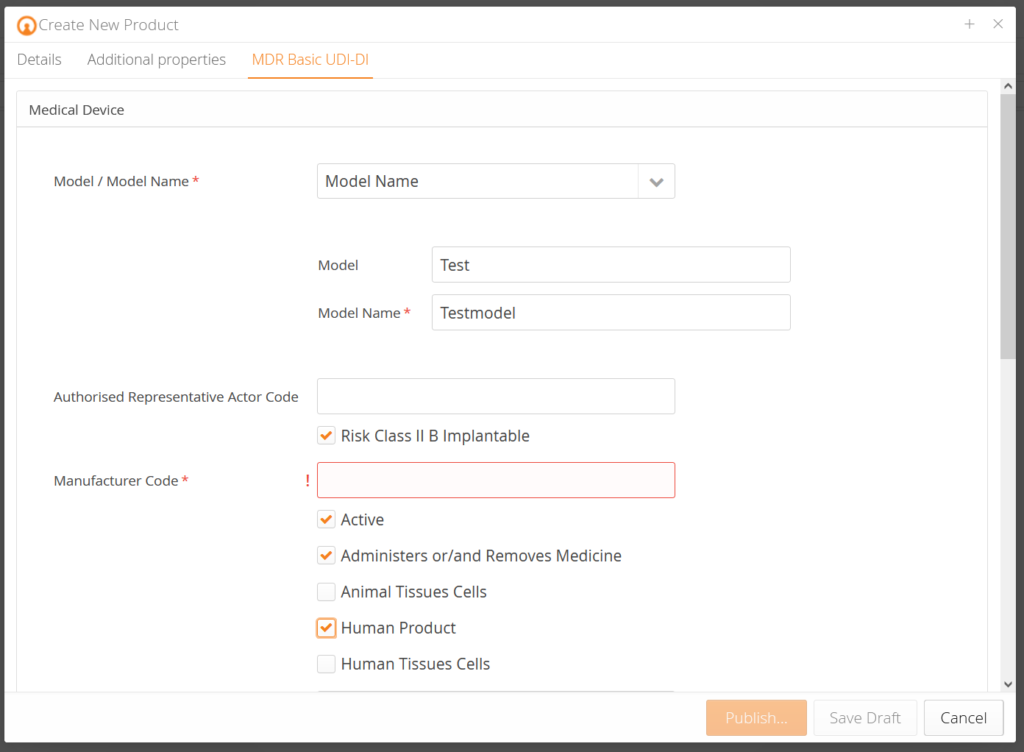
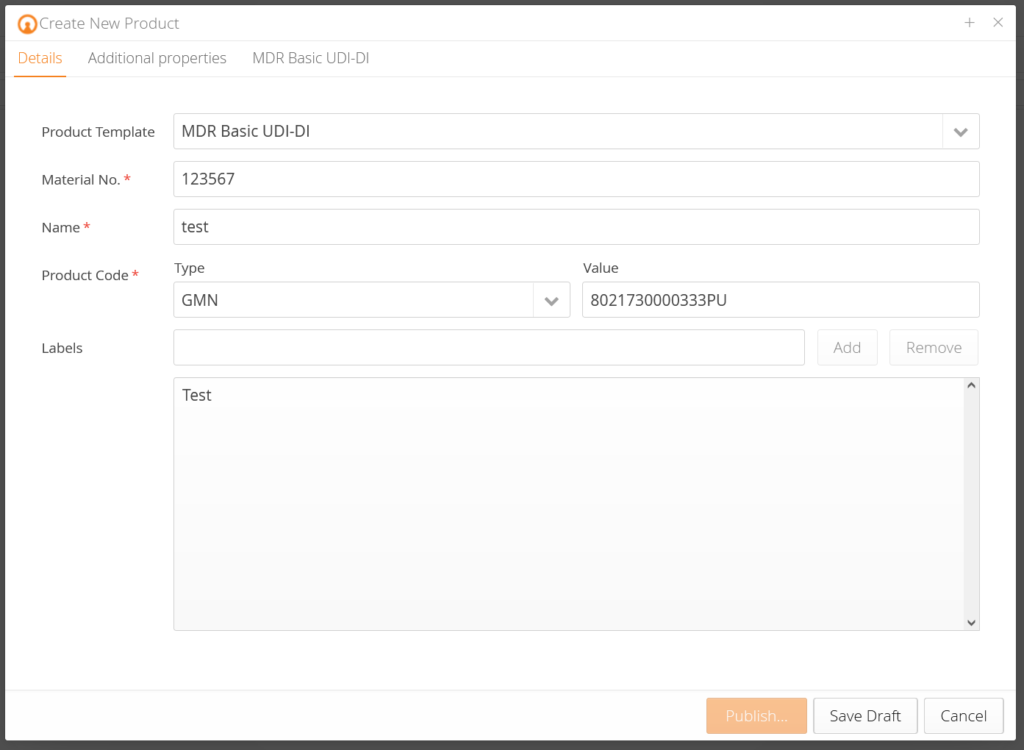
Unsere Kunden bekommen vorkonzipierte Datenmasken, die je nach Produkt entsprechende Produktdaten abfragen und diese anhand der EUDAMED Anforderungen vorvalidieren. Zusätzlich gibt es zu jedem Datenfeld eine Erklärung, sodass Sie genau wissen, welche Daten gefordert sind. Anhand der Änderungshistorie (Audittrail) wissen Sie, wer was zu welchem Zeitpunkt geändert hat. Traceability – ganz einfach.
Herausforderungen gezielt angehen:
Anforderungen an Datenqualität: Unsere Lösung validiert Ihre Daten vor und bildet Produkthierarchien ab.
Reporting an Behörden: Behördenreporting gehört zu unserem Alltag, ob über automatisierte Schnittstellen oder manuelle Workflows, unser System und unser Team wissen, wie es geht.
Einbindung der Supply Chain: Unsere Lösung fungiert als zentrales System, in dem nach Bedarf Businesspartner angeschlossen werden können, sodass einem eindeutigen und dokumentierten Datenaustausch nichts im Wege steht.
Internationale Regularien: Wir wissen, dass ein System nur zukunftsfähig ist, wenn es sich flexibel an zukünftige Anforderungen anpassen lässt. Deshalb haben wir auch die internationalen Anforderungen im Blick.
Nah am Kunden: Unsere modular aufgebauten Support-Angebote richten sich an den Bedürfnissen der Kunden aus. Egal bei welchem Modell, uns liegt es am Herzen, unsere Kunden bestmöglich zu unterstützen.
Wie wird mytracekey MedTech implementiert?
Die Implementierungszeit ist abhängig von der Anzahl Ihrer Produkte. Zum Einstieg bekommen Sie von uns ein Intensivtraining, um die neuen Prozesse und das System kennenzulernen. Nach dem Intensivtraining können Sie abschätzen, an welcher Stelle Ihnen noch Produktdaten fehlen. Als Cloud-System ist unser Service sofort einsatzbereit.
Wir unterstützen Sie bei MDR und UDI

Laden Sie hier unser Whitepaper zum Thema „In 7 Schritten zur UDI Compliance“ herunter. Download Whitepaper MDR-UDI Compliance
-> Verschaffen Sie sich einen Überblick über die Module der EUDAMED
-> Können Sie mit Ihrem ERP-System die MDR Anforderungen erfüllen?
-> Wir haben hilfreiches Informationsmaterial zur MDR und IVDR für Sie zusammengestellt