
Kennen Sie diese Situation, in der Sie einen Beipackzettel ungeduldig durchblättern, auf der Suche nach der richtigen Antwort auf Ihre Frage? Oder wenn Sie das kleine Blättchen frustriert, zurück in die Verpackung stopfen, weil Sie es einfach nicht schaffen, die Packungsbeilage wieder passend zusammenzufalten? Es wäre doch viel einfacher, die Gebrauchsinformation für ein Arzneimittel auf Ihrem Smartphone aufzurufen. Wenn Sie diese Gedanken kennen oder sich aus regulatorischer Sicht für das Thema interessieren, sind Sie hier genau richtig. Denn in unserem Artikel geht es um die elektronische Produktinformation für Medikamente, abgekürzt ePI.
Im Januar 2020 haben sich die Europäische Arzneimittelbehörde (EMA), die Leitung der europäischen Zulassungsbehörden (HMA) und die Europäische Kommission zusammengesetzt und überlegt, welche Prinzipien für die Entwicklung eines digitalen Beipackzettels gelten sollten. Auch außerhalb der EU gibt es schon einige Pilotprojekte zu diesem Thema mit spannenden Ansätzen.
Was ist eine elektronische Produktinformation (ePI)?
In Europa und den meisten anderen Ländern dieser Welt ist die Abgabe eines Beipackzettels gesetzlich vorgeschrieben, um Ärzt:innen, Apotheker:innen und Patient:innen über die sichere Anwendung eines Medikamentes zu informieren. Die elektronische Variante der Produktinformation verfolgt das gleiche Ziel, nur dass sie neben der Gebrauchsanweisung, auch eine Zusammenfassung der Produkteigenschaften (SmPC) und die Etikettierungsvorgaben für die Arzneimittelverpackung enthält.
Bei einer ePI handelt es sich in der Regel um eine Datei im Format XML, JSON oder RDF. Verglichen mit anderen digitalen Standards wie MS Word oder PDF, sind Daten aus diesem Format leicht extrahierbar, ohne dass ihre äußere Struktur verloren geht. So wird der elektronische Informationsaustausch zwischen Behörden und Herstellern über Web-Portale oder digitale Plattformen vereinfacht und eine digitale Nachbearbeitung ermöglicht.
Welche Vorteile gibt es?
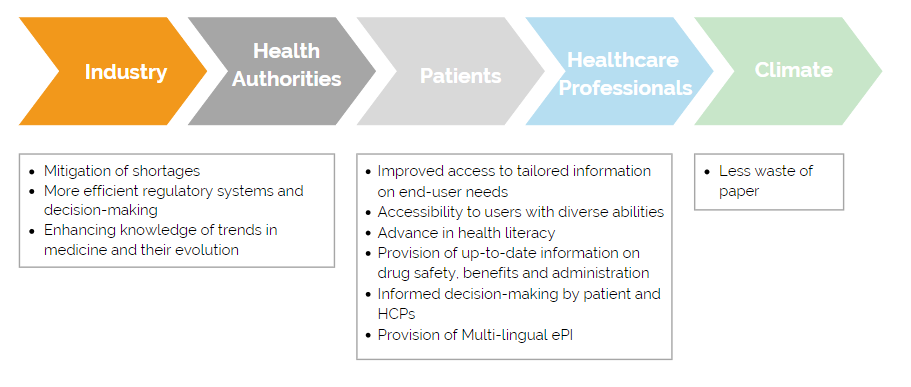
Die Coronakrise hat gezeigt, wie wichtig es ist digital zusammenzuarbeiten und in kurzer Zeit Entscheidungen zu treffen. Dies gilt auch für den Austausch zwischen Industrie und Behörden. Hersteller können ePIs nutzen um Meldungen zu aktuellen Therapieverfahren, Erkrankungen und deren Ursachen regelmäßig an Behörden weiterzuleiten. Mittels ePIs könnten Behörden auch schneller von der Industrie über Arzneimittelengpässe informiert werden und effizientere Maßnahmen ergreifen, wie die Umverteilung von Medikamenten in andere EU-Mitgliedsländer. Patient:innen und medizinisches Fachpersonal wären durch ePIs stets mit den neuesten Informationen zum jeweiligen Arzneimittel versorgt. Regulatorische Änderungen von Produktinformationen müssten nicht erst auf den nächsten Druck eines neuen Beipackzettels in der jeweiligen Landessprache warten. Dies ist vorteilhaft, da die Patient:innen, egal in welchem Land sie ein Medikament erwerben, den Beipackzettel in ihrer präferierten Sprache lesen könnten. Je nach Situation könnte man in Zukunft vielleicht ganz auf eine Papiervariante der Gebrauchsinformation verzichten.
Welche Herausforderungen bestehen?
Neben offensichtlichen Vorteilen bringt die Entwicklung von ePIs auch einige Herausforderungen mit sich. Wichtig für die Koordination eines solchen Projektes ist ein offener Dialog zwischen allen Beteiligten. Zum Beispiel hinsichtlich der Entscheidung über ein einheitliches ePI-Format, eine ausreichende Finanzierung und die Einbettung der ePIs in bestehende, nationale oder internationale Telematikstrukturen.
Eine Frage, die international viel diskutiert und je nach Land unterschiedlich gehandhabt wird, ist wie Patient:innen Zugang zu der digitalen Packungsbeilage erhalten. Indien schlägt vor, die Produktinformationen auf der Website des Herstellers bereitzustellen, während Taiwan eine zentrale Verwaltung der Daten durch die TFDA plant. Wird der Websitelink in einen QR-Code eingebettet, kann er mit jedem Smartphone gescannt werden, beansprucht jedoch zusätzlichen Raum auf der Arzneimittelverpackung. Viele Vertreter der pharmazeutischen Industrie schlagen daher eine Integration des Websitelinks in die GS1 Datenmatrix vor, sowie die Entwicklung einer Scanner-App im Rahmen eines internationalen Projektes. In den Vereinigten Arabischen Emiraten hat man sich dafür entschieden, der Diskussion ganz aus dem Weg zu gehen und beide Codes als verpflichtend einzuführen. Für alle anderen Länder empfiehlt die GS1, sich mit lokalen Behörden und GS1 Vertretern in Verbindung zu setzen, um mehr zu erfahren und gegebenenfalls Einfluss auf die entstehenden Regularien zu nehmen.