
Die EUDAMED verbessert Transparenz und Koordinierung von Informationen zu Medizinprodukten. Häufig brilliert sie jedoch durch ihre Komplexität. Hauptbestandteil dieser Komplexität sind ihre sechs Module, wovon erst drei freigeschaltet und nutzbar sind. Ein konkretes Veröffentlichungsdatum für die restlichen drei Module gibt es bisher noch nicht. Informationsmaterialien der EU sind oft schwer verständlich und werfen zum Teil mehr Fragen auf als sie beantworten.
Nichtsdestotrotz ist ein generelles Verständnis der EUDAMED essenziell. Die Nutzung wird nach einer Übergangsphase nämlich verpflichtend, sobald das gesamte System funktional ist. Unzureichende Vorbereitung und ein nicht Einhalten der Regularien kann so zu Umsatzeinbußen führen, falls Produkte nicht auf den Markt gebracht werden dürfen. Allerdings sei zu erwähnen, dass nicht jedes Modul für alle Nutzer:innen relevant ist. Daher stellt dieser Artikel die Basics der sechs EUDAMED Module vor und erläutert ihre Funktionen.
Actor registration bzw. Registrierung von Wirtschaftsakteuren
Obwohl sie bereits freigeschaltet ist, ist eine Registrierung von Wirtschaftsakteuren bisher nicht verpflichtend. Sie müssen sich jedoch bis zum Termin der EUDAMED Freischaltung registriert haben. Als Wirtschaftsakteure zählen: Hersteller, autorisierte Vertreter, Hersteller von Systemen & Behandlungseinheiten und Importeure. Weiterhin müssen alle Nutzer:innen eines Unternehmens, welche später in der EUDAMED arbeiten, sich registrieren. Zu beachten ist, dass ein Unternehmen sich dort registriert, wo es seinen Sitz hat und nicht dort wo die Produkte auf den Markt kommen. Nach der Registrierung wird eine SRN (Single Registration Number) angelegt und dient als einzigartige Identifizierung der Wirtschaftsakteure. Weiterhin müssen sie über mindestens eine Person mit dem erforderlichen Fachwissen über Medizinprodukte in ihrer Organisation verfügen. Diese Person ist für die Einhaltung der MDR Regularien zuständig. Ziel der „Actor registration“ ist es eine größtmögliche Transparenz für Kund:innen von medizinischen Geräten zu schaffen. Deren Hersteller sind nämlich über dieses EUDAMED Modul ersichtlich.
UDI/Devices registration bzw. UDI-/Produktregistrierung
Beim zweiten der sechs EUDAMED Module dreht es sich um ein System zur Identifikation von medizinischen Geräten durch einzigartige Seriennummern, der Unique Device Identification oder kurz: UDI. Hersteller tragen hier die wichtigsten Informationen ihrer Produkte für den Markt der Europäischen Union in der EUDAMED ein. Diese sollen der Öffentlichkeit zur Verfügung gestellt werden. Ziel der „UDI/Devices registration“ ist es, die Rückverfolgbarkeit einzelner Chargen, die Warenüberprüfung im Qualitätsmanagement und die Identifikation in der Logistik zu gewährleisten. Die Registrierung erfolgt nach der European Medical Devices Nomenclature (EMDN). Unterschieden wird hier in „Regulation Devices“, „Legacy Devices, und “Other Devices”.
Notified Bodies and Certificates bzw. Benannte Stellen und Zertifikate
Eine Benannte Stelle ist eine Organisation zur Prüfung von Anforderungen an medizinischen Produkten, bevor sie auf den Markt kommen. Sie werden von einem EU-Mitgliedsstaat dazu berechtigt. Benannte Stellen sind zum Beispiel der TÜV Rheinland oder DEKRA. Sie werden auch Konformitätsbewertungsstelle genannt und vergeben die notwendigen Zertifikate, damit Hersteller ihre Produkte verkaufen dürfen. Die Benannten Stellen sind dazu verpflichtet die vergebenen Zertifikate, sowie diesbezügliche Änderungen und Ergänzungen in der EUDAMED zu registrieren. Alle Informationen und Zertifikate sind auch hier für die Öffentlichkeit einzusehen.
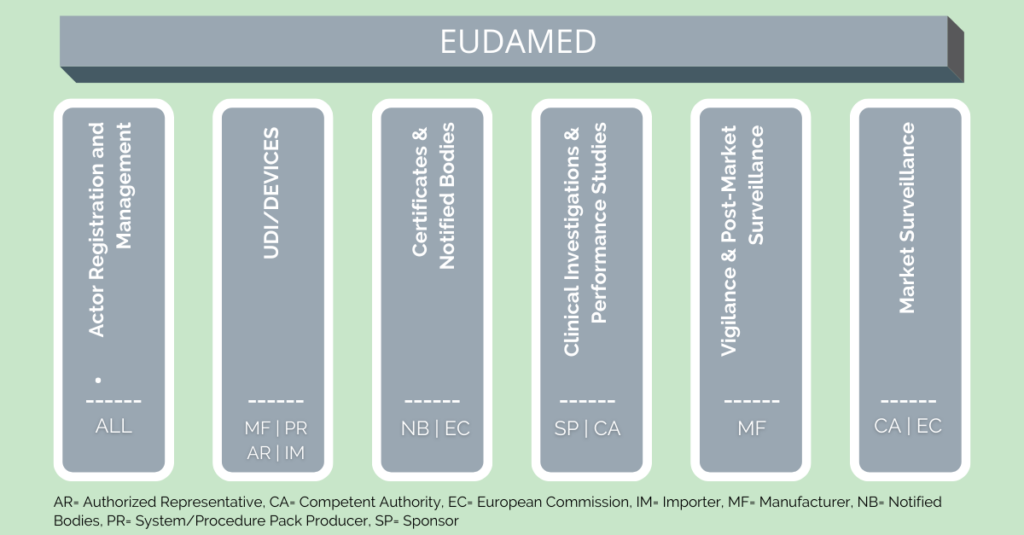
Clinical Investigations and performance studies bzw. klinische Bewertungen und Prüfungen
Im Zuge der EUDAMED werden die darunter registrierten Produkte teilweise klinischen Bewertungen unterzogen. Dabei wird systematisch untersucht, ob die Produkte halten, was sie versprechen und ob sie sicher für Patient:innen sind. Tests dieser Art sind notwendig, wenn zu wenig klinische Daten zu den Produkten vorhanden sind. So werden ausreichend Daten erhoben, um den Vertrieb am europäischen Markt zu ermöglichen.
Vigilance and post-market surveillance bzw. Vigilanz und Überwachung nach dem Inverkehrbringen
Das EUDAMED Modul Überwachung nach dem Inverkehrbringen, kurz PMS, ist selbsterklärend. Es ist Teil des Vigilanz-Systems der EUDAMED. Mit Vigilanz bezieht sich die Medical Device Regulation (MDR) auf das Überwachungs- und Report-System von medizinischen Geräten. Da Hersteller ein möglichst sicheres Produkt auf den Markt bringen möchten, durchlaufen sie viele Tests. Diese werden durch zuständige Behörden und Benannte Stellen überwacht. Manche Risiken entstehen allerdings erst nach einer gewissen Zeit. Das Ziel der PMS ist ein systematisches Aufdecken dieser Risiken, während die Produkte genutzt werden, eine Überwachung ihrer Leistung im Gebrauch sowie ein Aufdecken von übersehenen Risiken. Außerdem findet so die Risiko-Nutzen-Bewertung durchgängig statt und die Rückrufe können im Zweifelsfall schnell organisiert werden.
Market Surveillance bzw. Marktüberwachung
Im Zuge der Marktüberwachung prüfen die zuständigen Behörden regelmäßig die Funktionstüchtigkeit und Sicherheit von medizinischen Geräten, die bereits auf dem Markt sind. Überprüfung der Unterlagen, physische Kontrollen und Laboruntersuchungen werden hierfür durchgeführt. Gefälschte und unsichere Produkte werden so vom Markt genommen, um die Sicherheit ihrer Nutzer:innen zu gewährleisten.
Die EUDAMED-Module sind komplexer als dieser Artikel abbildet. Er soll lediglich als Einstieg auf dem Weg zur Compliance dienen. Ein Partner mit jahrelanger Erfahrung wie tracekey kann dabei helfen diese Compliance zu erreichen. Zusätzlich hat die Europäische Kommission im Oktober 2023 eine Verlängerung der Übergangsfrist für die EUDAMED angekündigt.